Pathobiologie et génétique de l’hypertension pulmonaire
Auteur·es:
Pre Dre méd. Dr h.c. Andrea Olschewski, MSc.1
Dr méd.Vasile Foris, MSc, PhD2,3
Pr Dr méd. Horst Olschewski4,5
1 Experimentelle Anästhesiologie Universitätsklinik für Anästhesiologie und Intensivmedizin
Medizinische Universität Graz
2 Klinische Abteilung für Pulmonologie Universitätsklinik für Innere Medizin
Medizinische Universität Graz
3 Channing Division of Network Medicine Department of Medicine
Brigham and Women’s Hospital, Harvard Medical School, Boston, MA, USA
4 Pulmologie und Experimentelle Medizin
Sigmund Freud Privatuniversität, Wien
5 Klinik für Pneumologie, Beatmungsmedizin und Intensivmedizin, mit Arbeitsbereich Schlafmedizin
Charité – Universitätsmedizin, Berlin
E-mail: andrea.olschewski@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Pour le 7e World Symposium on Pulmonary Hypertension (WSPH) en 2024, deux task forces composées de 17 expert·es internationaux·ales se sont penchées uniquement sur les mécanismes pathologiques, en se basant sur les principes biologiques (task force Pathobiology) et génétiques (task force Genetics) de l’hypertension pulmonaire. Même si les connaissances et les progrès de ces dernières années sont impressionnants, de grands défis subsistent.
Pathobiologie
L’hypertension pulmonaire (HTP) est une maladie complexe et hétérogène qui se caractérise par un processus pathologique de remodelage vasculaire pulmonaire. Les petites artères en particulier, mais aussi les petites veines, sont touchées, ce qui entraîne une élévation de la résistance vasculaire pulmonaire (RVP). Cela sollicite le ventricule droit et peut finalement entraîner une décompensation cardiaque droite.
Les causes de l’HTP sont multiples et ne sont pas encore totalement comprises. Nous continuons donc à parler de formes idiopathiques ainsi que d’états pathologiques dans lesquels l’HTP est associée à d’autres maladies (Tab. 1), par exemple l’insuffisance cardiaque chronique, les maladies pulmonaires chroniques ou les maladies du tissu conjonctif.1
Modifications pathologiques et diversité histologique
Le remodelage vasculaire est un mécanisme central de l’HTP. Les lésions plexiformes, qui surviennent notamment dans l’hypertension artérielle pulmonaire (HTAP) idiopathique, sont caractéristiques. Parallèlement, on constate toujours une prolifération cellulaire dans la paroi vasculaire. La diversité biologique entre les sous-types de HTP rend difficile le développement de traitements standardisés. Les lésions oblitérantes associées à une fibrose intimale significative dominent le plus souvent dans le cas de l’HTAP, tandis que les patient·es atteint·es de bronchopneumopathie chronique obstructive (BPCO) ou de fibrose pulmonaire idiopathique (FPI) présentent plus souvent une prolifération des cellules musculaires dans la paroi vasculaire. Il existe toutefois de grandes différences individuelles. Cette diversité explique la nécessité d’approches thérapeutiques spécifiques.
Mécanismes moléculaires et influences épigénétiques
La dérégulation de certaines voies de signalisation moléculaires est un élément central des mécanismes pathologiques. Actuellement, l’accent est mis sur la voie de signalisation «transforming growth factor(TGF)-β/bone morphogenetic protein (BMP)». Des mutations génétiques, par exemple dans le gène du récepteur de type2 au BMP (BMPR2), et une signalisation hyperactive de l’activine favorisent à la fois le remodelage vasculaire et les processus inflammatoires. Sur la base d’études précliniques portant sur des inhibiteurs de l’activine2, un inhibiteur de l’activine ayant montré des effets cliniques plus significatifs que prévu dans l’HTAP sévère a récemment été approuvé pour le traitement de celle-ci.3
Les modifications épigénétiques jouent également un rôle important. L’augmentation de la méthylation de l’ADN et de l’acétylation des histones favorise les processus de remodelage pathologiques. Les enzymes telles que l’histone déacétylase (HDAC) et l’histone méthyltransférase EZH2 sont régulées à la hausse en cas d’HTP. Les inhibiteurs de ces modificateurs épigénétiques ont révélé des effets positifs dans des modèles précliniques et offrent des approches potentielles pour des traitements futurs.
Adaptations métaboliques et nouveaux biomarqueurs
Les modifications métaboliques, telles qu’une production accrue d’acétyl-CoA, influencent les modifications épigénétiques comme l’acétylation des histones et favorisent ainsi la prolifération cellulaire. D’autres cibles moléculaires, telles que la modification de l’ARN N6-méthyladénosine ainsi que le «long non coding (lnc)RNA», ont été identifiées comme des facteurs importants de la pathogenèse de l’HTP.
L’identification de nouveaux biomarqueurs est d’une grande importance pour l’amélioration du diagnostic et du pronostic. Outre les marqueurs établis comme le «brain natriuretic peptide» (BNP), des facteurs circulants comme le GDF15, l’IL-6 et l’activineA donnent des résultats intéressants4, mais les facteurs métaboliques comme l’augmentation des acides gras prennent également de plus en plus d’importance.5
Les technologies modernes telles que l’intelligence artificielle (IA) et l’apprentissage automatique accélèrent l’analyse d’ensembles de données complexes et ouvrent la voie à des traitements plus précis et personnalisés.
Canaux ioniques
Les canaux ioniques jouent un rôle central dans la régulation du tonus vasculaire pulmonaire et dans la pathogenèse de l’HTP. Les progrès récents de la recherche ont mis l’accent sur les canaux potassiques, calciques et sodiques spécifiques. Les dysfonctionnements des canaux potassiques contribuent à la vasoconstriction et à la prolifération des cellules musculaires lisses, ce qui augmente la résistance vasculaire. Ces mécanismes sont par exemple impliqués dans l’action de la prostacycline et de l’endothéline,6 et d’autres stratégies thérapeutiques sont en cours de développement.7
Un autre domaine de recherche se concentre sur les canaux «transient receptor potential» (TRP), qui jouent un rôle important dans l’homéostasie du calcium intracellulaire. Les canaux TRP hyperactifs favorisent l’inflammation et le remodelage vasculaire, c’est pourquoi les inhibiteurs de TRP font actuellement l’objet d’études précliniques.
Différences spécifiques au sexe
Un phénomène mal compris est le fait que les femmes sont certes plus souvent atteintes d’HTAP que les hommes, mais elles peuvent vivre plus longtemps avec la maladie. L’interaction entre les différents facteurs génétiques, hormonaux et épigénétiques est très complexe. Les œstrogènes jouent un double rôle, car ils favorisent d’une part le remodelage vasculaire, mais améliorent d’autre part la capacité d’adaptation du ventricule droit.
Progrès de la recherche
Les innovations technologiques telles que la transcriptomique unicellulaire et la transcriptomique spatiale ont révolutionné la compréhension de la pathogenèse de l’HTP. Ces méthodes permettent d’identifier de nouveaux marqueurs moléculaires et populations de cellules, ce qui a permis de mettre en évidence des mécanismes jusqu’alors inconnus. Les approches multiomiques révèlent l’hétérogénéité moléculaire des lésions d’HTP et fournissent de nouvelles cibles thérapeutiques.
Modèles et nouvelles approches pour l’examen de la maladie
L’utilisation de cellules souches pluripotentes induites (CSPi) a permis de développer des modèles de maladie humains qui, à bien des égards, reproduisent mieux les mécanismes de l’HTP que les modèles animaux. Les modèles de culture 3D complexes, tels que le «lung-on-a-chip» ou les organoïdes, permettent d’étudier les interactions cellulaires avec précision. Des coupes pulmonaires de précision (PCLS) permettent de simuler des modifications in vivo de la structure vasculaire et de tester de nouveaux médicaments.
Défis et perspectives
Malgré les progrès réalisés, la cause réelle de l’HTAP idiopathique reste inconnue et l’hétérogénéité de la maladie constitue un défi majeur. L’intégration des données individuelles des patient·es dans la recherche et les approches thérapeutiques est essentielle. Une amélioration des modèles précliniques et des progrès dans la recherche de biomarqueurs pourraient accélérer le succès translationnel. Les approches technologiques telles que la transcriptomique spatiale et les analyses basées sur l’IA pourraient faire progresser les traitements personnalisés et réduire la charge de morbidité à long terme.
Développements génétiques et hypertension pulmonaire
La recherche génétique a gagné en importance depuis la découverte des mutations de BMPR2 il y a 25 ans. Les mutations génétiques jouent un rôle central dans l’HTAP héréditaire, mais c’est souvent le test génétique qui révèle qu’il ne s’agit pas d’une HTAP idiopathique, mais d’une HTAP héréditaire. Par conséquent, un tel test est recommandé pour l’ensemble des patient·es atteint·es d’HTAP héréditaire, d’HTAP idiopathique ainsi que les personnes atteintes de maladies pulmonaires ou cardiaques congénitales et d’HTP. Une mutation génétique causale peut également être présente dans les rares cas de «pulmonary veno-occlusive disease» (PVOD).8
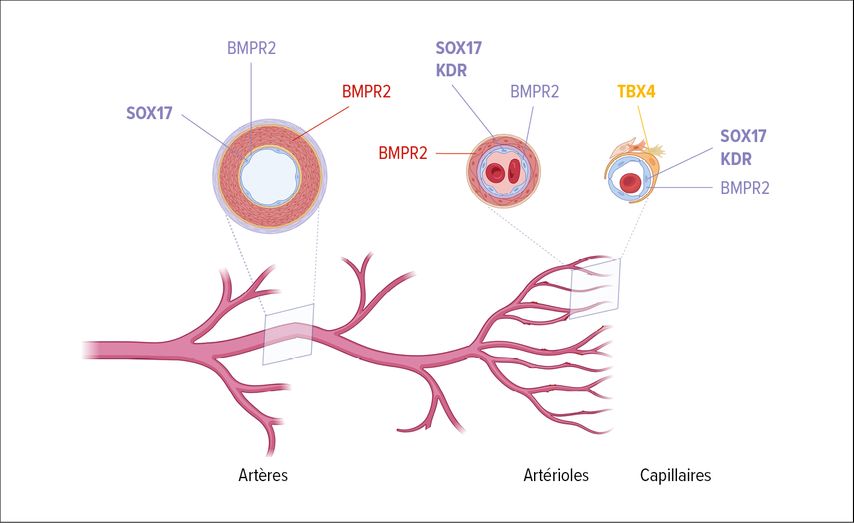
Bien que les mutations de BMPR2 soient la cause la plus fréquente de l’HTAP héréditaire, des mutations dans de nombreux autres gènes peuvent en être la cause. Les mutations de SOX17, TBX4, KDR et EIF2AK4 entraînent des phénotypes d’HTP spécifiques. Ainsi, des mutations de SOX17 ont été observées aussi bien chez les enfants que chez les adultes. Ces mutations influencent la fonction des cellules endothéliales et la morphogenèse vasculaire par le biais d’éléments régulateurs, ce qui constitue un point de départ pour des approches thérapeutiques plus précises (Fig. 1).9
Fig.1: Gènes nouvellement identifiés dans la pathobiologie de l’HTAP (créée avec https://app.biorender.com )
Les mutations de TBX4 sont associées à des troubles du développement pulmonaire, dont une réduction de l’alvéolisation et un remodelage vasculaire. Les personnes atteintes présentent souvent des anomalies bronchiques et des modifications parenchymateuses qui entraînent une diminution de la capacité de diffusion du monoxyde de carbone (DLCO). Il est intéressant de noter que les mutations de TBX4 peuvent se présenter sous forme de délétion (chez les enfants) ou d’insertion (chez les adultes), ce qui provoque des tableaux cliniques différents. Les mutations de TBX4 représentent le deuxième groupe le plus fréquent après les mutations de BMPR2 et présentent une légère prévalence chez les femmes. Ces mutations mettent en évidence l’importance des gènes qui contrôlent le développement alvéolaire et vasculaire, et marquent des cibles thérapeutiques potentielles.10
Le gène KDR, qui code pour le «vascular endothelial growth factor receptor-2» (VEGFR-2), est un facteur clé de l’angiogenèse. Des mutations dans ce gène influencent la liaison du VEGF-A, un médiateur central de la néovascularisation. Des mutations de KDR ont été identifiées chez les enfants et les adultes, et sont associées à un remodelage vasculaire ainsi qu’à des modifications vasculaires pulmonaires sévères. Ces découvertes soulignent le rôle de l’angiogenèse dans la pathogenèse de l’HTP et offrent de nouvelles options thérapeutiques qui pourraient cibler le VEGFR-2.11
Des mutations dans le gène EIF2AK4 sont la cause de la PVOD héréditaire à transmission récessive. Ces patient·es se distinguent par leur plus jeune âge au moment du diagnostic, si on les compare aux patient·es atteint·es de PVOD idiopathique, plus fréquent·es.
Ensemble, ces mécanismes génétiques montrent non seulement la diversité des contributions génétiques à l’HTP, mais aussi leur importance potentielle pour le développement d’approches diagnostiques et thérapeutiques plus précises.
Progrès dans la thérapie génique
La thérapie génique offre de nouvelles approches pour le traitement de l’HTP. Des méthodes telles que l’insertion de gènes, l’édition de gènes (p.ex. CRISPR-Cas9) et les oligonucléotides antisens sont en cours de développement. Les premières applications de ces technologies dans d’autres maladies, comme la fibrose kystique, laissent espérer une transposition à l’HTP. Le défi consiste à définir la fenêtre temporelle appropriée pour les interventions thérapeutiques, avant la survenue de lésions vasculaires irréversibles.
Signification clinique et test génétique
Les tests génétiques s’imposent de plus en plus comme l’examen de référence pour le diagnostic de l’HTAP. L’identification des variantes pathogènes aide non seulement à l’évaluation pronostique, mais permet également de fournir des conseils avisés aux familles. La consultation en génétique est essentielle pour soutenir les décisions en matière de reproduction et les stratégies de surveillance à long terme.
Défis et perspectives
Même si les progrès de ces dernières années sont impressionnants, de grands défis subsistent. La diversité pathobiologique et l’hétérogénéité génétique de l’HTP nécessitent des cohortes plus grandes et diversifiées afin d’identifier et de mieux comprendre les formes rares. Des approches orientées vers l’avenir, telles que la combinaison d’analyses basées sur l’IA avec la multiomique, pourraient fournir de nouvelles connaissances révolutionnaires. À long terme, la médecine de précision va bouleverser non seulement le diagnostic et le traitement, mais aussi la prévention de l’HTP.
Littérature:
1 Kovacs G et al.: Eur Respir J 2024; 64: 2401324 2 Guignabert C et al.: Circulation 2023; 147: 1809-22 3 Hoeper MM et al.: N Engl J Med 2023; 388: 1478-90 4 Dardi F et al.: Eur Respir J 2024; 64: 2401323 5 Bordag N et al.: medRxiv 2023; https://doi.org/10.1101/2023.05.17.23289772 6 Li Y et al.: Am J Respir Cell Mol Biol 2012; 46: 372-9 7 Csaki R et al.: Br J Pharmacol 2024; 181: 3576-93 8 Austin ED et al.: Eur Respir J 2024; 64: 2401370 9 Montani D et al.: Eur Respir J 2022; 60: 2200656 10 Karolak JA et al.: Am J Respir Crit Care Med 2023; 207: 855-64 11Swietlik EM et al.: Circ Genom Precis Med 2020; 14: e003155
Das könnte Sie auch interessieren:
Redéfinition de la résécabilité à l’ère de l’immunothérapie
L’introduction de l’immunothérapie néoadjuvante a ouvert de nouveaux horizons quant aux limites de la résection chirurgicale des tumeurs du cancer du poumon. Toutefois, des problèmes ...
La perte de poids reste toujours le meilleur traitement en cas de MASLD
La directive commune pour la prise en charge de la maladie stéatosique du foie associée à une dysfonction métabolique (MASLD) de l’European Association for the Study of the Liver (EASL ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...