Adjuvante Strahlentherapiein Zeiten moderner Systemtherapien
Autorin:
Prof. Dr. Mechthild Krause
Direktorin
Klinik für Strahlentherapie und Radioonkologie Universitätsklinikum Dresden
E-Mail: mechthild.krause@ukdd.de
Adjuvante Strahlentherapie bleibt trotz der Fortschritte mit Immun- und zielgerichteten Therapien ein zentraler Baustein in der Behandlung kutaner Malignome. Sie verbessert die lokoregionäre Kontrolle und bietet funktionelle sowie kosmetische Vorteile, gerade im Bereich von Gesicht und Hals, wo sie auch als primäre kurative Therapieoption eingesetzt wird. Moderne Systemtherapien ergänzen die Strahlentherapie um systemische Effekte. Entscheidend für den Therapieerfolg ist das richtige Zeitfenster in der Kombination beider Ansätze.
Keypoints
-
Adjuvante Strahlentherapie senkt das Risiko für lokoregionäre Rezidive bei Patient:innen mit Risikofaktoren, ein Überlebensvorteil konnte bislang nur retrospektiv für Plattenepithelkarzinome mit Risikofaktoren gezeigt werden.
-
Immuntherapien und „targeted therapies“ erzielen vor allem systemische, aber auch lokoregionäre Effekte.
-
Frühzeitige Integration von Immuntherapien nach RT scheint entscheidend zu sein.
-
Zukünftig werden Biomarker benötigt, die Patient:innen für adjuvante Bestrahlung allein, Bestrahlung + Systemtherapie oder Systemtherapie allein selektionieren.
Evidenzlage zur adjuvanten Strahlentherapie
Malignes Melanom
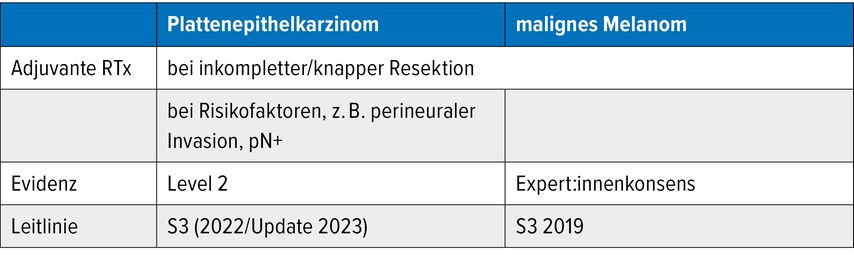
Die Phase-III-Studie von Henderson et al.1 randomisierte nach Lymphadenektomie teilnehmende Patient:innen auf adjuvante Bestrahlung und Verzicht auf adjuvante Bestrahlung (Beobachtung). Es zeigten sich signifikant weniger nodale Rezidive in der Bestrahlungsgruppe, jedoch kein Vorteil im Gesamtüberleben. Letztlich besteht hier eine Indikation zur adjuvanten Strahlentherapie nur bei inkompletter oder knapper Resektion ohne Möglichkeit der Nachresektion (Tab.1).
Tab. 1: Leitliniengerechte Indikationen zur adjuvanten Strahlentherapie bei kutanen Plattenepithelkarzinomen und malignen Melanomen
Plattenepithelkarzinom
Zur adjuvanten Bestrahlung beim Plattenepithelkarzinom fehlen randomisiert-kontrollierte Studien. Retrospektive Analysen deuten Vorteile in Hochrisikosubgruppen an, etwa bei perineuraler Invasion oder nodalem Befall, zum Beispiel in einer Studie von Harris et al.2 Metaanalysen zeigen sogar Überlebensvorteile für solche Patient:innengruppen.3,4 Insgesamt basiert die Evidenz bisher auf Level-II-Daten und unterstützt neben der Strahlentherapie nach inkompletter oder knapper Resektion auch die adjuvante Strahlentherapie bei Patient:innen mit Risikofaktoren wie oben genannt (Tab.1).
Moderne Systemtherapien in Kombination mit Strahlentherapie
Malignes Melanom
Eine wichtige Studie ist jene von Long et al. zur adjuvanten Therapie mit Dabrafenib/Trametinib, die bei Melanomen im Stadium III mit BRAF-Mutation ein verlängertes rezidivfreies Überleben und einen statistischen Trend für ein verlängertes Gesamtüberleben zeigt.5 Strahlentherapie war hier zusätzlich erlaubt, aber nicht Teil des Studienprotokolls. Unklar bleibt hier, ob und welche Patient:innen zusätzlich zu dieser modernen zielgerichteten Therapie noch eine Strahlentherapie brauchen. In den randomisierten Studien zur adjuvanten Immuntherapie wurden in der Regel Patient:innen mit R0-Resektion eingeschlossen, sodass hier keine Strahlentherapie zusätzlich durchgeführt wurde.
Plattenepithelkarzinom
Die Phase-III-Studie C-POST zeigte, dass der Anti-PD-1-Antikörper Cemiplimab nach Operation und adjuvanter Strahlentherapie das krankheitsfreie Überleben signifikant verlängert (HR: 0,32; p<0,001).6 Auch die lokoregionäre Kontrolle und die Freiheit von Fernmetastasen waren verbessert. Da hier alle Patient:innen aufgrund ihrer klinischen Risikokonstellation eine Strahlentherapie vor der Immuntherapie erhielten, ist der Effekt der Strahlentherapie nicht separat auswertbar.
Wichtig zu wissen ist, dass die KEYNOTE-630-Studie mit adjuvanter Therapie mit Pembrolizumab negativ blieb. Diese unterschied sich durch eine spätere Randomisierung (größerer Abstand der Immuntherapie zur Strahlentherapie) und stärkere Patient:innenselektion, indem explizit Patient:innen mit lokalem Rezidivrisiko eingeschlossen wurden, während in C-POST viele Patient:innen mit regionärem Rezidivrisiko behandelt wurden.
Praxisimplikationen
Die Strahlentherapie bleibt eine relevante adjuvante Therapie bei malignen Melanomen und Plattenepithelkarzinomen der Haut. Sie ist ein gezieltes Werkzeug für lokoregionäre Kontrolle. Entscheidend bei der zusätzlichen Applikation moderner Systemtherapien scheint das Timing zu sein, die Daten legen nahe, dass Immuntherapie möglichst früh nach der Strahlentherapie starten sollte, um Synergien zu nutzen.
Ausblick
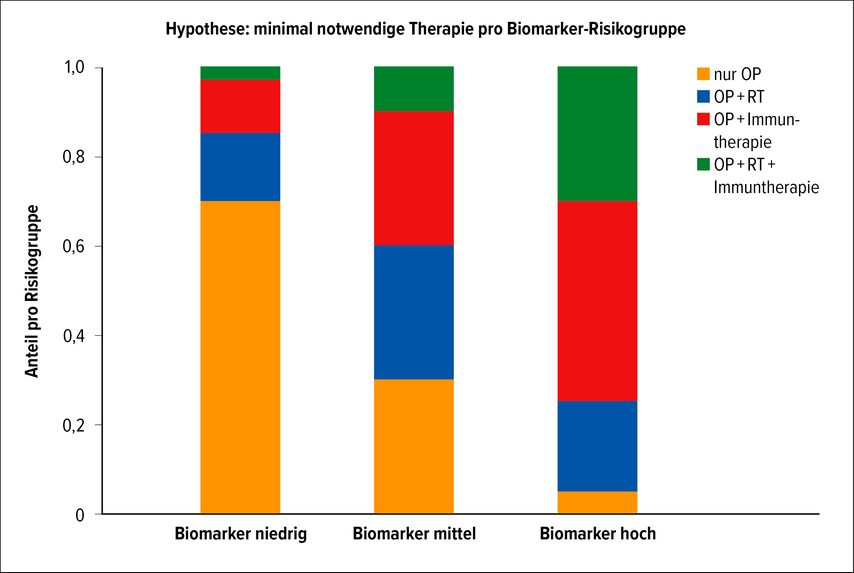
Die Zukunft der adjuvanten Therapie liegt in multimodalen Konzepten. Die Rolle der adjuvanten Strahlentherapie in Zusammenhang mit modernen Systemtherapien könnte durch randomisierte Studien besser geklärt werden, was die Teilnahme vieler Zentren erfordert. Essenziell ist die Entwicklung starker personalisierter Therapiestrategien, um eine Überbehandlung bestimmter Patient:innengruppen durch die multimodale Therapie zu vermeiden und den Patient:innen mit besonders hohem Risiko für einen Tumorprogress eine optimale Therapie zukommen zu lassen (Abb.1 als hypothetisches Beispiel). Gleichzeitig müssen hier gezielt Aspekte der Kosteneffizienz mit untersucht werden.
Abb. 1: Hypothetische Abbildung für eine „minimal notwendige Therapie“ nach Biomarker-Analyse. Bei niedriger Biomarker-Expression profitieren viele Patient:innen schon von der Operation (OP), die adjuvanten Therapien geben jede für sich für eine relevante Gruppe aber noch einen zusätzlichen Effekt, der durch eine Tripelkombination nicht mehr gesteigert werden kann. Bei höherer Biomarkerexpression steigt der Effekt der multimodalen Therapie. Abbildung erstellt mit Unterstützung von ChatGPT
Insgesamt bleibt die Strahlentherapie eine wichtige Säule für eine Subgruppe von Patient:innen, als Partner moderner Systemtherapien.
Literatur:
1 Henderson MA et al.: Adjuvant lymph-node field radiotherapy versus observation only in patients with melanoma at high risk of further lymph-node field relapse after lymphadenectomy (ANZMTG 01.02/TROG 02.01): 6-year follow-up of a phase 3, randomised controlled trial. Lancet Oncol 2015; 16(9): 1049-60 2 Harris BN et al.: Association of adjuvant radiation therapy with survival in patients with advanced cutaneous squamous cell carcinoma of the head and neck. JAMA Otolaryngol Head Neck Surg 2019; 145(2): 153-8 3 Zhang J et al.: Efficacy and prognostic factors of adjuvant radiotherapy for cutaneous squamous cell carcinoma: a systematic review and meta-analysis. J Eur Acad Dermatol Venereol 2021; 35(9): 1777- 87 4 Sahovaler A et al.: Outcomes of cutaneous squamous cell carcinoma in the head and neck region with regional lymph node metastasis: a systematic review and meta-analysis. JAMA Otolaryngol Head Neck Surg 2019; 145(4): 352-60 5 Long GV et al.: Final results for adjuvant dabrafenib plus trametinib in stage iii melanoma. N Engl J Med 2024; 391(18): 1709-20 6 Rischin D et al.: Adjuvant cemiplimab or placebo in high-risk cutaneous squamous-cell carcinoma. N Engl J Med 2025; 393(8): 774-85
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...