Checkpoint-Inhibitoren als wichtiger Bestandteil in allen Krankheitsphasen
Bericht:
Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In diesem Jahr wurden beim ASCO 2025 für die Behandlung des Nierenzellkarzinoms Langzeitdaten präsentiert, die unsere jetzigen immuntherapeutischen Standards bestätigen. Zudem wurden richtungsweisende neue Kombinationen und Wirksubstanzen vorgestellt.
Keypoints
-
KEYNOTE-564-Langzeitstudiendaten bestätigen Pembrolizumab als Therapiestandard für Patient:innen mit einem erhöhten Rezidivrisiko.
-
Die lange CheckMate241-Nachbeobachtungszeit bestätigt die Vorteile der Erstlinientherapie mit Nivolumab plus Ipilimumab gegenüber Sunitinib.
-
Vielversprechende Wirksamkeit mit akzeptabler Toxizitätliegt bei Zanzalintinib plus Nivolumab in der PhaseII der STELLAR-304-Studie bei unbehandeltem lokal fortgeschrittenem oder metastasiertem RCC vor.
-
Eine Kombination von Casdatifan mit Cabozantinib gegen die alleinige Cabozantinibtherapie wird placebokontrolliert geprüft.
Mit der Phase-III-Studie KEYNOTE-564 wurde ein Vorteil durch die adjuvante Therapie mit Pembrolizumab für Patient:innen mit klarzelligem Nierenzellkarzinom (RCC) und mittlerem bis hohem Rezidivrisiko nach Nephrektomie erreicht. Die im Rahmen des ASCO Kongress 2025 präsentierten 5-Jahres-Daten bestätigen den anhaltenden Nutzen der Therapie.1
5-Jahres-Daten bestätigen adjuvantes Pembrolizumab
In der randomisierten, placebokontrollierten Phase-III-Studie KEYNOTE-564 erhielten 994 an einem RCC Erkrankte nach Nephrektomie über die Dauer von einem Jahr Pembrolizumab (200mg, q3w) oder Placebo. Primärer Studienendpunkt war das krankheitsfreie Überleben (DFS). Mit einer medianen Nachbeobachtungszeit von 69,5 Monaten war der Median für das DFS im Pembrolizumab-Arm noch nicht erreicht und betrug im Placebo-Arm 68,3 Monate. Die Kaplan-Meier-Kurven separierten nach etwa 3 Monaten und verliefen kontinuierlich parallel. Der Anteil an krankheitsfreien Patient:innen betrug im Pembrolizumab- und im Kontrollarm nach 60 Monaten 60,9% vs. 52,2% und nach 72 Monaten 58,5% vs. 48,7%. Das Risiko für einen Krankheitsprogress wurde mit der adjuvanten Pembrolizumab-Gabe um 29% reduziert (HR: 0,71; 95% CI: 0,59–0,86).
Der DFS-Vorteil übertrug sich auch auf das Gesamtüberleben (OS). Das Risiko zu versterben wurde um 34% reduziert (HR: 0,44; 95% CI: 0,48–0,90; Abb.1).
Nach 60 Monaten lebten 87,7% vs. 82,3% der Patient:innen in den beiden Studienarmen und nach 72 Monaten 86,1% vs. 79,4%. Es wurden keine neuen klinisch relevanten therapieassoziierten Nebenwirkungen berichtet.
Pembrolizumab ist die einzige adjuvante Therapie beim RCC, die eine OS-Verlängerung nachweisen konnte. Die Langzeitergebnisse der KEYNOTE-564-Studie bestätigen Pembrolizumab als Therapiestandard für Patient:innen mit einem erhöhten Rezidivrisiko.
Finale Ergebnisse zur Erstlinien-therapie in CheckMate214-Studie
Mit 9,3 Jahren medianer Nachbeobachtungszeit wurden im Rahmen des ASCO Kongress die finalen Ergebnisse der CheckMate214-Studie präsentiert.2 Auf Basis der Studiendaten wurden Nivolumab plus Ipilimumab für die Erstlinientherapie von RCC-Patient:innen mit mittlerem und hohem Rezidivrisiko laut IMDC-Kriterien zugelassen. Als Kontrolle wurde die frühere Standardbehandlung mit Sunitinib gewählt. Primärer Studienendpunkt waren das OS, das progressionsfreie Überleben (PFS) und die objektive Ansprechrate (ORR) von Patient:innen mit mittlerem und hohem Rezidivrisiko.
Insgesamt wurden 1096 Patient:innen eingeschlossen, von denen 23% eine gute, 61% eine mittlere und 16% eine schlechte Prognose aufwiesen. Bei 68–69% der Erkrankten lagen Lungenmetastasen vor, bei 20–22% wurden Knochenmetastasen festgestellt und bei 18–20% war die Leber involviert.
Die finalen Ergebnisse bestätigten die Checkpoint-Inhibitor(ICI)-Kombination für Patient:innen mit mittlerem oder hohem Rezidivrisiko. Auch nach 9 Jahren blieben die Kaplan-Meier-Kurven separiert. Die 9-Jahres-OS-Rate lag bei 30% mit Nivolumab plus Ipilimumab versus 19% unter Sunitinib. Das Risiko zu sterben war im ICI-Arm um 31% vs. den TKI-Arm reduziert (HR: 0,69; 95% CI: 0,59–0,81). Die PFS-Rate lag nach 9 Jahren bei 25% vs. 9%, mit einer Reduktion des Risikos für einen Progress oder Tod von 27% (HR: 0,73; 95% CI: 0,61–0,87). Patient:innen zeigten unter der ICI-Therapie länger anhaltende Ansprechen als unter Sunitinib. Im Median betrug die Dauer des Ansprechens (DOR) 82,8 vs. 19,8 Monate (HR: 0,48; 95% CI: 0,33–0,69).
Auch für Patient:innen mit guter Prognose wurde mit der langen Nachbeobachtungszeit ein möglicher Nutzen von Nivolumab plus Ipilimumab bezüglich des OS (HR: 0,80; 95% CI: 0,59–1,09) und der DOR (HR: 0,74; 95% CI: 0,39–1,41) gesehen.
Insgesamt wurde für die ITT-Population im experimentellen Arm ein verlängertes OS (HR: 0,74; 95% CI: 0,64–0,85) sowie ein Trend für ein verlängertes PFS (HR: 0,88; 95% CI: 0,76–1,04) beobachtet. Nach 9 Jahren lag die OS-Rate bei 31% vs. 20% und die PFS-Rate lag nach 8 Jahren bei 23% versus 9%. Während sich die OS-Kaplan-Meier-Kurven früh separierten, trennten sich die PFS-Kurven nach 24 Monaten, blieben dann aber konsistent vorteilhafter für die ICI-Therapie. Ein Ansprechen wurde bei 39,5% vs. 33,0% der Patient:innen in den beiden Studienarmen gesehen, mit mehr Komplettremissionen unter der ICI-Therapie im Vergleich zu Sunitinib und einer längeren DOR (HR: 0,53; 95% CI: 0,38–0,73).
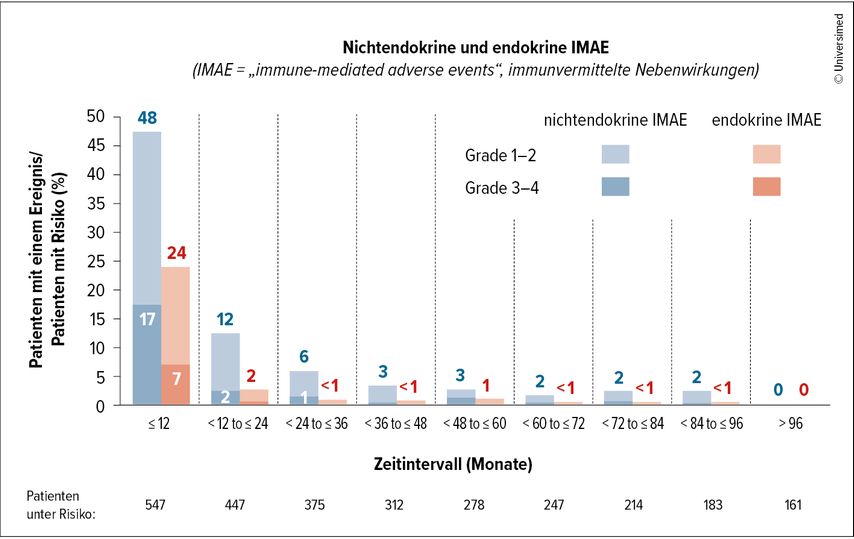
Mit der langen Nachbeobachtungszeit wurden keine neuen Sicherheitssignale beobachtet. Ereignisse vom Grad≥3 wurden für 49% der Patient:innen im Nivolumab-plus-Ipilimumab- und 64% im Sunitinib-Arm berichtet. Die meisten immunassoziierten Nebenwirkungen traten früh im Verlauf der Behandlung auf (Abb.2).
Abb. 2: Nichtendokrine und endokrine immunvermittelte Nebenwirkungen im Verlauf der Therapie mit Nivolumab plus Ipilimumab (nach Choueiri TK et al. 2025)2
Mit einer langen Nachbeobachtungszeit von mehr als 9 Jahren bestätigen die finalen Ergebnisse der CheckMate214-Studie den Vorteil der Erstlinientherapie mit Nivolumab plus Ipilimumab gegenüber Sunitinib. Die Verträglichkeit mit langer Nachbeobachtung war konsistent mit früheren Sicherheitsanalysen.
Experimentelle Kombination zeigt neue Möglichkeiten auf
Zanzalintinib ist ein TKI der nächsten Generation, der an die Zielstrukturen MET, VEGFR2 und die TAM-Kinasen (TYRO3, AXL und MER) bindet. Damit wird insbesondere die Immunsuppression der Tumormikroumgebung adressiert. In Kombination mit den Checkpoint-Inhibitoren Nivolumab (Anti-PD-1) und Relatlimab (Anti-LAG3) wurde Zanzalintinib in der offenen Phase-II-Studie STELLAR-002 als Erstlinientherapie beim RCC geprüft.3 Patient:innen erhielten Zanzalintinib plus Nivolumab sowie sequenziell zugeordnet Relatlimab oder kein Relatlimab. Primärer Endpunkt waren die Inzidenz und Schwere der Nebenwirkungen sowie die ORR gemäß „Response Evaluation Criteria in Solid Tumors“ (RECIST) v1.1.
In beide Studienarme wurden je 40 Patient:innen eingeschlossen, die ein medianes Alter von 68 bzw. 61 Jahren aufwiesen. 90% bzw. 65% der Erkrankten waren nephrektomiert. Bei 25% bzw. 30% der Patient:innen lag eine gute Prognose laut IMDC-Risikoscore vor,bei 75% bzw. 70% ein mittleres bis hohes Rezidivrisiko.
Im Ergebnis wurde ein Ansprechen bei 63% vs. 40% der Patient:innen ohne bzw. mit Relatlimab gesehen. Die Krankheitskontrollrate lag bei 90%. Die mediane Dauer des Ansprechens war mit einer Nachbeobachtungszeit von 20 bzw. 16 Monaten in beiden Studienarmen noch nicht erreicht. Nach 12 Monaten waren 73,4% vs. 74,1% der ansprechenden Patient:innen weiterhin in Remission. Das PFS betrug im Median 18,5 vs. 13,0 Monate, mit einer 6-Monats-Rate von 83,4% vs. 80,4% und einer12-Monats-Rate von 64,4% vs. 58,4%.
Die Exposition gegenüber der Studienmedikation war mit 16,1 Monaten vs. 10,9 Monate länger im Studienarm mit Zanzalintinib plus Nivolumab. Insgesamt war Zanzalintinib in Kombination mit Nivolumab mit oder ohne Relatlimab gut tolerierbar.
Mit der vielversprechenden Wirksamkeit und akzeptablen Toxizität wird die Kombination von Zanzalintinib plus Nivolumab in der Phase-III-Studie STELLAR-304 bei Patient:innen mit unbehandeltem lokal fortgeschrittenem oder metastasiertem RCC weiterentwickelt.
Casdatifan plus Cabozantinib bei vorbehandelten Patient:innen
HIF-2α ist ein wichtiger Treiber in der Entwicklung und Progression des nicht-klarzelligen RCC. Der neue HIF-2α-Inhibitor Casdatifan wurde in der Phase-I-Studie ARC-20 mit Cabozantinib bei Anti-PD-(L)1-vorbehandelten RCC-Patient:innen untersucht. In den Dosisexpansionsteil der Studie wurden je Dosiskohorte etwa 30 Patient:innen eingeschlossen, die Casdatifan als Monotherapie oder in Kombination mit Cabozantinib erhielten.
Die Sicherheitspopulation des Casdatifan-plus-Cabozantinib-Expansionsteils vereinigte 42 Patient:innen in einem medianen Alter von 63 Jahren. 83% der Betroffenen hatten bereits eine vorangegangene Therapie, 17% zwei oder mehr Therapielinien erhalten. Die Vorbehandlung bestand bei 60% der Patient:innen aus einer alleinigen immunonkologischen Therapie und bei 40% aus einem VEGFR-TKI plus einem ICI. Bezüglich des Ansprechens konnten 24 Patient:innen mit einer medianen Nachbeobachtungszeit von 5,3 Monaten ausgewertet werden. Eine Remission erreichten 46% der Patient:innen, eine Komplettremission 4%. Bei der Hälfte der Kohorte stabilisierte sich die Erkrankung. Nur bei einem Teilnehmer schritt die Erkrankung fort.
An Nebenwirkungen traten insbesondere Anämie und Fatigue auf, die in den meisten Fällen keine Dosisanpassungen benötigten und wieder ausheilten. Es wurden keine Casdatifan-assoziierten Grad-4- oder -5-Nebenwirkungen beobachtet. Nur 2 Patient:innen brachen eine der beiden Studiensubstanzen ab,keine:r brach beide ab.
Casdatifan (100mg, qd) plus Cabozantinib (60mg, qd) zeigen vielversprechende klinische Aktivität bei vorbehandelten RCC-Patient:innen. Das Sicherheitsprofil war gut handhabbar. Die Ergebnisse der ARC-20-Studie stützen die Weiterentwicklung von Casdatifan, beispielsweise in der Phase-III-Studie PEAK, in der Casdatifan in Kombination mit Cabozantinib gegen die alleinige Cabozantinib-Therapie placebokontrolliert geprüft wird.
Quelle:
Jahrestagung der American Society of Clinical Oncology (ASCO), 30. Mai bis 3. Juni 2025, Chicago
Literatur:
1 Haas NB et al.: Five-year follow-up results from the phase 3 KEYNOTE-564 study of adjuvant Pembrolizumab for the treatment of clear cell renal cell carcinoma (ccRCC). Präsentiert am ASCO-Kongress 2025; Abstr.No.4514 2 Choueiri TK et al.: Nivolumab plus Ipilimumab vs Sunitinib for first-line treatment of advanced renal cell carcinoma: final analysis from the phase 3 CheckMate 214 trial. Präsentiert am ASCO Kongress 2025; Abstr.No.4505 3 Chahoud J et al.: Zanzalintinib+Nivolumab±Relatlimab in patients with previously untreated clear cell renal cell carcinoma: results from an expansion cohort of the phase 1b STELLAR-002 study. Präsentiert am ASCO-Kongress 2025; Abstr.No.4515 4 Choueiri TK et al.: Combination Casdatifan plus Cabozantinib in previously treated patients with clear cell renal cell carcinoma: results from the expansion cohort of the phase 1 ARC-20 study. ASCO 2025; Abstr.No.4506
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Fortschritte beim Urothelkarzinom
Für die urologischen Entitäten konnten beim diesjährigen Jahreskongress der American Society of Clinical Oncology viele wichtige Fortschritte verzeichnet werden. Insbesondere die ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...
%20unter%20Therapie%20mit%20Pembrolizumab%20versus%20Placebo.jpg)