Influence de la pullulation bactérienne de l’intestin grêle chez les patient·es atteint·es de MICI
Auteures:
Dre méd. Agnieszka Kafel
Pre Dre méd. Elisabeth Schnoy
Dre méd. Julia Wanzl
III. Medizinische Klinik
Universitätsklinikum Augsburg
Auteure correspondante:
Pre Dre méd. Elisabeth Schnoy
E-mail: elisabeth.schnoy@uk-augsburg.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les douleurs abdominales sont un problème fréquent que l’on rencontre à l’hôpital comme au cabinet. Les diagnostics différentiels peuvent être nombreux. Une pullulation bactérienne peut être à l’origine de ces symptômes. Il s’agit d’une entité pathologique qui est rarement envisagée au quotidien et qui peut également se manifester fréquemment dans le cadre de maladies chroniques telles que les maladies inflammatoires chroniques de l’intestin (MICI). L’identification et le traitement relèvent souvent d’un défi clinique, et sont décrits en détail ci-dessous.
Keypoints
-
En cas de douleurs abdominales, il faut également envisager une pullulation bactérienne (SIBO).
-
Les symptômes d’une SIBO et d’une MICI peuvent se ressembler.
-
Une méthode simple de dépistage de la SIBO est le test respiratoire.
-
Selon les directives existantes, la rifaximine est l’antibiotique de référence dans la SIBO.
Les symptômes généraux et non spécifiques, tels que les nausées, le météorisme, les douleurs abdominales ou l’irrégularité et la modification de la consistance des selles, peuvent cacher plusieurs entités pathologiques, en premier lieu des maladies de la sphère gastroentérologique. Pour détecter les causes sous-jacentes, on procède généralement à un diagnostic par étapes, en commençant par un examen clinique, un diagnostic de laboratoire, une échographie abdominale ou, si ceux-ci ne sont pas concluants, un examen endoscopique complémentaire. Les symptômes décrits ci-dessus accompagnent souvent pendant des années également les patient·es atteint·es de MICI. Ce groupe de maladies comprend la maladie de Crohn (MC), la colite ulcéreuse (CU) et la colite indéterminée. Toutes les formes évoluent généralement par poussées, avec des phases de rémission et de maladie active. L’activité de la maladie peut être contrôlée de différentes manières, notamment par une anamnèse ciblée, une analyse de laboratoire, une analyse des selles (calprotectine), un diagnostic endoscopique, histologique ou par imagerie, comme l’échographie ou l’IRM.
Dans la pratique clinique quotidienne, on peut toutefois observer une persistance des troubles avec les symptômes mentionnés ci-dessus en l’absence d’une poussée de MICI. Dans de tels cas, le diagnostic différentiel doit envisager une pullulation bactérienne de l’intestin grêle («small intestine bacterial overgrowth», SIBO).
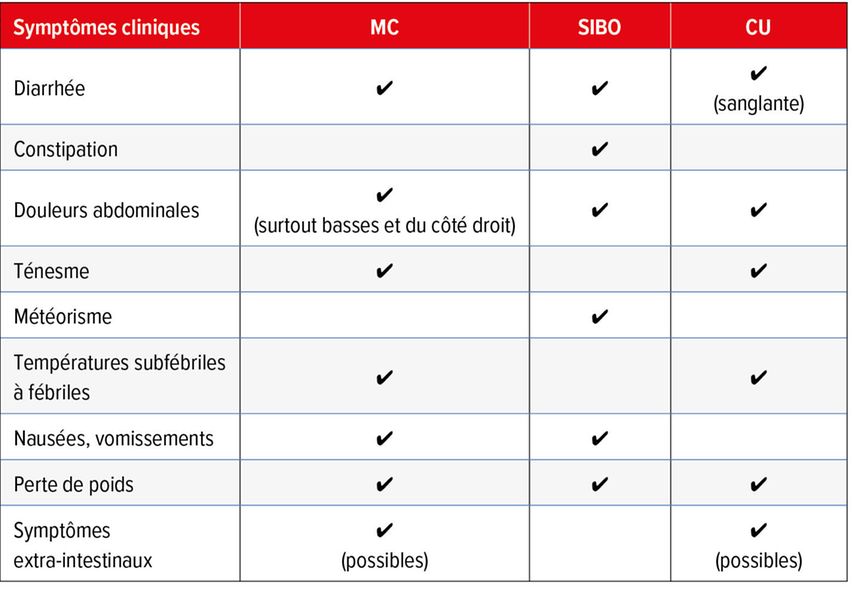
En présence d’une SIBO, les patient·es se plaignent de symptômes similaires à ceux des personnes atteintes de MICI active (Tab.1), de sorte qu’il est souvent difficile de faire la distinction clinique entre les deux entités pathologiques.
Tab. 1: Symptômes cliniques de la maladie de Crohn (MC), de la pullulation bactérienne de l’intestin grêle (SIBO) et de la colite ulcéreuse (CU)
La pullulation bactérienne se caractérise par une colonisation pathologique de l’intestin grêle par différentes bactéries fermentant les glucides, principalement à Gram négatif. Cela entraîne la production de quantités excessives de gaz et l’accumulation de divers produits de dégradation, ce qui peut provoquer des symptômes cliniques désagréables pour les patient·es, tels que des douleurs et un météorisme prononcé.1 Cet état pathologique peut être causé, entre autres, par des constipations qui entraînent un déséquilibre de la flore intestinale. Une prévalence élevée de SIBO chez les personnes atteinte du syndrome du côlon irritable avec constipation a déjà été démontrée.2 En général, la SIBO peut être causée par une mauvaise digestion ou une malabsorption due à une modification de l’anatomie (p.ex. dysfonctionnement ou absence de fonction de la valvule iléo-cæcale, voire résection iléo-cæcale) ou un trouble de la motilité, à une altération de la production d’acide gastrique, à un trouble du transit intestinal, p.ex. postopératoire, à des maladies hépatiques ou rénales, ou à une insuffisance pancréatique.3, 4 Chez les patient·es atteint·es de MC, la survenue de la pullulation peut être favorisée par une inflammation chronique dans la région de l’intestin grêle.2 Dans ce groupe, on rapporte une prévalence de SIBO comprise entre 25 et 88%, surtout chez les patient·es dont l’évolution de la maladie est compliquée.1 Dans la population normale, la prévalence de la SIBO se situe entre 2,5 et 20%, et augmente avec l’âge ainsi qu’en cas de multimorbidité.5
Bien diagnostiquer la SIBO
Le diagnostic de référence d’une SIBO est invasif et implique un prélèvement de liquide (env. 3ml) dans le duodénum/intestin grêle, suivi d’une culture microbiologique.1, 3 Le diagnostic d’une SIBO peut être posé en cas de détection d’un nombre de bactéries >103UFC/ml.1 Dans la réalité, le diagnostic par test respiratoire au glucose ou au lactulose est toutefois recommandé en raison de son caractère non invasif, de sa facilité de mise en œuvre et de son coût inférieur.1,3 Il ne faut cependant pas oublier que la sensibilité (test respiratoire au glucose: 52–63%; test respiratoire au lactulose: 31–68%) et la spécificité (test respiratoire au glucose: 82–86%; test respiratoire au lactulose: 44–100%) pour évaluer plus précisément l’expression de la maladie sont plutôt aléatoires.1,3
Avant d’effectuer le test respiratoire, 75g de glucose sont dissous dans 200ml d’eau, puis la solution est bue par les patient·es. Ensuite, la concentration d’hydrogène dans l’air expiré est mesurée toutes les 15minutes pendant 3heures. Dans le cas du test respiratoire au lactulose, 15ml de solution (y compris 10g de substrat) sont bus et les mesures sont effectuées pendant 4heures.6 La concentration d’hydrogène (H2), de méthane (CH4) et/ou de dioxyde de carbone (CO2) est mesurée dans l’air expiré. En présence d’une SIBO, on mesure une concentration élevée de H2/CH4 par rapport aux personnes en bonne santé. Le résultat est considéré comme pathologique si la concentration d’H2 augmente de 20ppm par rapport à la valeur initiale après 90minutes et/ou si la concentration de méthane augmente de ≥10ppm pendant 2heures après le début de l’examen.1
Un deuxième critère pour poser le diagnostic de SIBO est ce que l’on appelle le «double peak». Après une première augmentation au bout d’environ 90min, on observe une baisse de plus de 5ppm dans les deux échantillons suivants. Ensuite, les valeurs des échantillons augmentent à nouveau. On parle alors de «double peak». Ce deuxième pic reflète la fermentation dans le côlon.
Une préparation adéquate en amont est décisive pour obtenir un bon résultat de test. Une antibiothérapie par voie orale ou intraveineuse doit être terminée 4semaines avant le test. De plus, il faut veiller à ne pas prendre de probiotiques 2semaines avant l’examen, d’inhibiteurs de la pompe à protons (IPP) 1semaine avant et de prokinétiques tels que le métoclopramide 48heures avant5, car les résultats peuvent sinon être faussés. L’examen est réalisé à jeun (8 à 12heures sans prise alimentaire). La consommation de nicotine ou d’alcool et l’activité physique doivent également être évitées.1,5
Bien traiter la SIBO
Il n’existe aucune directive spécifique en allemand ou dans une autre langue européenne sur le traitement de la SIBO. La directive S3 de l’AWMF (Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V.) sur les troubles de la motilité intestinale aborde certes régulièrement le sujet de la pullulation bactérienne, mais ne donne qu’une seule recommandation thérapeutique.7 L’American College of Gastroenterology fournit des conseils plus détaillés sur le traitement et a consacré une directive à la SIBO.8 Il convient tout d’abord de noter, conformément aux Clinical Practice Guidelines de Quigley et al., que le traitement de la SIBO doit, dans la mesure du possible, commencer par la maladie sous-jacente, par exemple l’élimination des sténoses sévères de l’intestin grêle ou des fistules colo-entériques.9,10 La plupart du temps, cela n’est toutefois pas possible, raison pour laquelle il faut alors recourir à d’autres options thérapeutiques.
Antibiotiques
L’antibiothérapie est le pilier du traitement de la SIBO, bien qu’il s’agisse d’un traitement beaucoup plus empirique que fondé sur des preuves.8 L’objectif n’est pas en premier lieu l’éradication de l’ensemble de la flore bactérienne, mais plutôt la modification du microbiote, qui doit par la suite conduire à une amélioration des symptômes.9,10
Rifaximine
Parmi les différents antibiotiques, la rifaximine est celui qui a fait l’objet du plus grand nombre d’études dans le traitement de la SIBO. La rifaximine est un antibiotique à large spectre appartenant au groupe des rifamycines et n’est absorbée par voie entérale que dans une faible mesure. Grâce à son action très locale, limitée à l’intestin, les effets secondaires systémiques sont, d’une part, rares et, d’autre part, le développement d’une résistance est également très restreint.11,12
Les études sur les effets de la rifaximine sont très hétérogènes, ce qui se reflète non seulement dans les doses utilisées, qui variaient de 600 à 1600mg/j, mais aussi dans la durée d’utilisation, qui allait de 5 à 28jours.13 Le taux d’éradication groupé dans la méta-analyse de Gatta et al. était de 70,8%.13 Selon les directives existantes, la rifaximine est l’antibiotique de référence dans la SIBO.7,8
Antibiotiques systémiques
Les données sur les antibiotiques systémiques tels que l’amoxicilline/acide clavulanique, la ciprofloxacine, la doxycycline, le métronidazole ou encore la norfloxacine, la tétracycline et le triméthoprime-sulfaméthoxazole sont peu nombreuses et ne concernent que des études cliniques portant sur un petit nombre de cas.8 Cependant, une réponse de la SIBO est également postulée pour ces antibiotiques.8
Traitement antibiotique en cas de rechute
Lauritano et al. ont pu montrer sur une petite cohorte de 80patient·es que le taux de récidive de la SIBO est déjà élevé après peu de temps et qu’il continue d’augmenter au fil du temps. Ainsi, 12,6% des patient·es ont été testé·es à nouveau positif·ves à la SIBO après seulement 3 mois, 27,5% après 6mois et 43,7% après 9mois. Un test respiratoire au glucose a été réalisé.13
Il n’existe aucune recommandation uniforme concernant le traitement de deuxième ligne ou de la récidive. Là encore, il n’existe que des recommandations empiriques et des avis d’expert·es qui préconisent de changer de schéma thérapeutique pour un autre antibiotique.8,9,14
Mesures diététiques
Les recommandations concernant la prise en charge diététique se basent en particulier sur celles en cas de syndrome du côlon irritable, qui est souvent associé à une SIBO. Le régime pauvre en FODMAP peut apporter un soulagement.15 Il s’agit de réduire l’apport en aliments rapidement fermentescibles, faiblement absorbés dans l’intestin grêle et osmotiquement actifs. FODMAP est l’acronyme pour «fermentescible oligosaccharides, disaccharides, monosaccharides and polyols». Concrètement, cela signifie renoncer par exemple aux pommes, aux poires, aux fruits secs, aux oignons, à l’ail, au blé, au seigle, au lait, au yaourt ou aux édulcorants comme le sorbitol, le mannitol et le xylitol.
Wielgosz-Grochowska et al. concluent, après avoir analysé 12études, qu’un régime pauvre en FODMAP peut améliorer les symptômes gastro-intestinaux chez les patient·es, mais qu’un régime à long terme peut avoir des effets négatifs, à savoir une augmentation des Bacteroides saccharolytiques, des Porphyromonadaceae et des Bilophilia asaccharolytiques.15 C’est également la conclusion de Reddel et al. qui ont étudié l’influence du régime pauvre en FODMAP et d’autres régimes sur le microbiote intestinal.16
Dans l’ensemble, les données relatives aux mesures diététiques, telles qu’elles sont recommandées dans le cas du syndrome du côlon irritable, ne sont pas concluantes dans le traitement de la SIBO et sont plutôt hypothétiques selon la littérature actuellement disponible.15 Cet avis est partagé de manière similaire par l’American College of Gastroenterology et d’autres auteur·es.9,17,18
Probiotiques
Les preuves concernant les probiotiques dans le cadre de la SIBO sont équivalentes à celles concernant les mesures diététiques: les données disponibles sont limitées et il n’existe aucun consensus clair sur le traitement probiotique de la SIBO.8, 5 Dans une étude sur le traitement de la SIBO par Bifidobacterium par rapport au placebo, 81% des patient·es du groupe sous traitement actif ont été traité·es avec succès par rapport à 25,4% dans le groupe sous placebo.5 Une amélioration significative des symptômes cliniques a également été rapportée dans le groupe sous traitement actif.5 De petites études, comme celle mentionnée ci-dessus, peuvent certes indiquer un effet des probiotiques, mais les preuves ne sont pas suffisantes à l’heure actuelle.5,14 De manière générale, il convient de noter que l’effet des probiotiques dépend de la souche probiotique administrée et qu’ils doivent donc être choisis en fonction de leurs propriétés spécifiques ainsi que de l’effet recherché.19
Prokinétiques
Bien que les prokinétiques soient très souvent mentionnés comme une option thérapeutique en cas de SIBO, il n’existe aucune donnée sur les prokinétiques dans la SIBO. La SIBO étant associée à des troubles de la motilité, on suppose toutefois que les médicaments correspondants ont un effet positif.20
La thèse de l’efficacité des prokinétiques dans la SIBO est soutenue par une étude menée en 2018 dans laquelle les personnes concernées ont été divisées en deux groupes: un groupe a reçu des IPP et l’autre des IPP + prokinétiques. Un test respiratoire à l’H2 au glucose et au lactulose a été réalisé dans les deux groupes et le temps de transit oro-cæcal a été consigné. Une SIBO a été diagnostiquée beaucoup plus souvent dans le groupe recevant uniquement des IPP que dans celui recevant des IPP + prokinétiques. De plus, le temps de transit oro-cæcal était plus long dans le groupe des patient·es SIBO-positif·ves que dans celui des patient·es SIBO-négatif·ves.21
D’autres études sont toutefois nécessaires pour pouvoir tirer des conclusions fondées sur des preuves quant aux effets.
Éviter la rechute
Comme expliqué ci-dessus, le taux de rechute est élevé après un traitement initialement réussi.13 Afin de mieux évaluer et, le cas échéant, de minimiser le risque de rechute, il est important de connaître les circonstances et les facteurs de risque qui peuvent conduire à une rechute. Il s’agit par exemple d’un trouble de la motilité intestinale, de modifications anatomiques telles que des tumeurs de l’intestin grêle, de diverticules de l’intestin grêle ou d’états postopératoires («blind loop», résection iléo-caecale, etc.), mais aussi de maladies systémiques telles que le diabète ou la sclérose systémique. Les médicaments tels que les IPP ou les opiacés peuvent également augmenter le risque de SIBO ou de rechute.8,14 Les patient·es atteint·es de MICI, et en particulier ceux·lles souffrant de MC, présentent souvent un risque accru de développer une SIBO en raison de l’inflammation et des états postopératoires fréquents en cas de résection iléo-cæcale. C’est pourquoi, notamment dans ces cas, il faut justement envisager une SIBO en cas de troubles persistants malgré une rémission.
Littérature:
1 Roszkowska P et al.: Biomedicines 2024; 12: 1030 2 Wanzl J et al.: J Clin Med 2023; 12: 935 3 Maeda Y, Murakami T: Antibiotics 2023; 12: 263 4 Avelar Rodriguez D et al.: Front Pediatr 2019. 7: 363 5 Skrzydlo-Radomanska B, Cukrowska B: J Clin Med 2022; 11: 6017 6 Ghoshal UC Srivastava D: IWorld J Gastroenterol 2014; 20: 2482-91 7 Keller J et al.: Z Gastroenterol 2022; 60: 192-218 8 Pimentel M et al.: Am J Gastroenterol 2020; 115: 165-78 9 Quigley EMM et al.: Gastroenterol 2020; 15: 1526-32 10 Scarpignato C, Gatta L: Aliment Pharmacol Ther 2013; 38: 1409-10 11 Scarpignato C, Pelosini I: Chemother 2005; 51(Suppl 1): 36-66 12 Calanni F et al.: J Antibiot 2014; 67: 667-70 13 Gatta L, Scarpignato C: Aliment Pharmacol Ther 2017; 45: 604-16 14 Silva BCD et al.: Arq Gastroenterol 2025; 62: e24107 15 Wielgosz-Grochowska JP et al.: Nutrients 2022; 14: 3382 16 Reddel S et al.: Nutrients 2019; 11: 373 17 Velasco-Aburto S et al.: Nutrients 2025; 17: 1410 18 Souza C et al.: World J Clin Cases 2022; 10: 4713-6 19 Bubnov RV et al.: EPMA J 2018; 9: 205-2320 Ghoshal UC et al.: Gut Liver 2017; 11: 196-208 21 Revaiah PC et al.: JGH Open 2018; 2: 47-53
Das könnte Sie auch interessieren:
Points forts du congrès ADA: de la gestion du poids à la thérapie par cellules souches
Du 20 au 23juin, les 85e sessions scientifiques de l’American Diabetes Association (ADA) se sont tenues à Chicago. Ce congrès, le plus grand rendez-vous mondial consacré à la recherche, ...
Principaux faits marquantsdu congrès EASL 2025
Le congrès de l’EASL s’est tenu à Amsterdam du 7 au 10 juin2025 et a réuni près de 7740participant·es issus de 119 pays. L’événement a couvert un large éventail de thématiques en ...
Plan de vaccination suisse 2025: nouveautés
Les principales nouveautés du plan de vaccination suisse 2025 concernent la prévention des maladies respiratoires. Le Dr méd. Alessandro Diana, pédiatre et infectiologue à Genève, membre ...