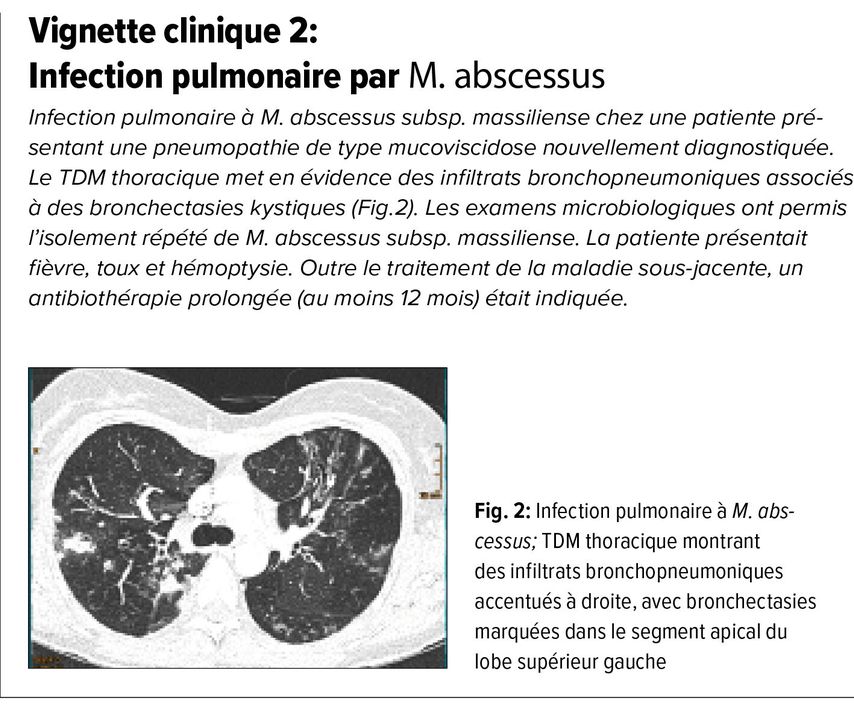
Mycobactéries non tuberculeuses (MNT): clinique, diagnostic et traitement
Auteur·es:
Dre méd. Marisa Kälin1
Dre sc. nat. Bettina Schulthess2
PD Dr méd. LucasBoeck3
PD Dr méd. Johannes Nemeth1
1 Klinik für Infektionskrankheiten und Spitalhygiene
Universitätsspital Zürich
2 Medizinische Mikrobiologie
Universität Zürich
3 Klinik für Pneumologie
Universitätsspital Basel
Auteur correspondant:
PD Dr méd. Johannes Nemeth
Klinik für Infektionskrankheiten und Spitalhygiene
Universitätsspital Zürich
E-mail: johannes.nemeth@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les infections dues aux mycobactéries non tuberculeuses connaissent une augmentation significative à l’échelle mondiale. Il demeure cliniquement difficile de différencier colonisation, infection transitoire et véritable maladie liée aux MNT. Un diagnostic rigoureux est essentiel, car les traitements antibiotiques sont très longs et souvent associés à de nombreux effets indésirables.
Les mycobactéries non tuberculeuses (MNT) regroupent plus de 200 espèces, dont certaines peuvent être responsables d’atteintes pulmonaires et extrapulmonaires chez l’homme. Contrairement à Mycobacterium tuberculosis, agent pathogène de la tuberculose, et à Mycobacterium leprae, agent pathogène de la lèpre, seules quelques espèces de MNT sont pathogènes.
L’incidence mondiale des MNT est en constante augmentation. Cette évolution reflète notamment les progrès diagnostiques, une vigilance clinique accrue ainsi que de possibles modifications environnementales. Par ailleurs, l’utilisation croissante de traitements immunosuppresseurs accroît la vulnérabilité aux infections par MNT et explique une proportion plus élevée de maladies cliniquement significatives. On observe également une hausse des infections nosocomiales cutanées et des tissus mous après interventions chirurgicales, surtout dans les régions où les normes d’hygiène hospitalière sont insuffisantes.
Épidémiologie et facteurs de risque
Les MNT sont ubiquistes, présentes dans l’eau et le sol. La transmission survient principalement par inhalation ou par inoculation directe via des plaies cutanées ou des lésions des tissus mous. Les facteurs de risque d’infection pulmonaire par MNT incluent les maladies pulmonaires structurelles (p.ex. bronchectasies, mucoviscidose, BPCO, antécédents de tuberculose) ainsi que l’immunosuppression. Un profil particulier concerne les femmes d’âge moyen, longilignes, souvent atteintes du «syndrome de Lady Windermere».
Classification des MNT
Les MNT se divisent en espèces à croissance lente et à croissance rapide. Les principales espèces pathogènes à croissance lente sont:
-
Mycobacterium avium complex (MAC)
-
Mycobacterium kansasii complex
-
Mycobacterium xenopi
Les principales espèces à croissance rapide sont:
-
Mycobacterium abscessus
-
Mycobacterium chelonae
-
Mycobacterium fortuitum
Tableau clinique
Les infections à MNT peuvent être pulmonaires ou extrapulmonaires (peau, tissus mous, ganglions lymphatiques, os, formes disséminées). L’atteinte pulmonaire se traduit par des symptômes pulmonaires tels qu’une toux chronique, des expectorations, une hémoptysie et des symptômes systémiques tels que perte de poids et asthénie. De nombreux·ses patient·es demeurent cependant paucisymptomatiques. L’imagerie révèle des bronchectasies, des lésions cavitaires ou des infiltrats nodulaires. Les formes extrapulmonaires dépendent du site atteint et s’accompagnent souvent de symptômes systémiques. Les adénopathies, les infections cutanées et des tissus mous ainsi que les ostéites figurent parmi les présentations typiques.
Diagnostic
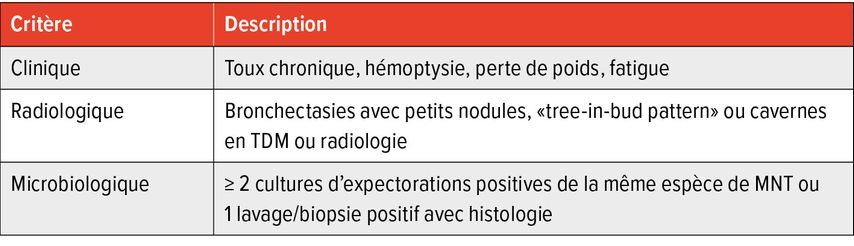
Selon les critères IDSA/ATS, le diagnostic d’une maladie pulmonaire à MNT repose sur l’association de symptômes cliniques (éventuellement en plus d’une maladie sous-jacente), d’anomalies radiologiques typiques et d’une confirmation microbiologique (Tab.1). Il est crucial de distinguer maladie par MNT, colonisation et infection transitoire, car les MNT peuvent être isolées fortuitement chez des patient·es asymptomatiques. Une détection respiratoire répétée rend improbable une clairance spontanée. Le diagnostic ne conduit pas systématiquement à un traitement: la décision dépend de la progression, du risque d’effets indésirables et des interactions. Ces incertitudes doivent être expliquées aux patient·s; la décision pour ou contre un traitement relève d’une démarche de «décision partagée».
Microbiologie et résistance
L’identification précise de l’espèce est déterminante, car la réponse thérapeutique varie fortement. Ainsi, M. abscessus présente souvent une résistance inductible aux macrolides. Cependant, cette résistance est absente chez la sous-espèce M.abscessus subsp. massiliense, ce qui autorise alors un traitement à base de macrolides.
Traitement
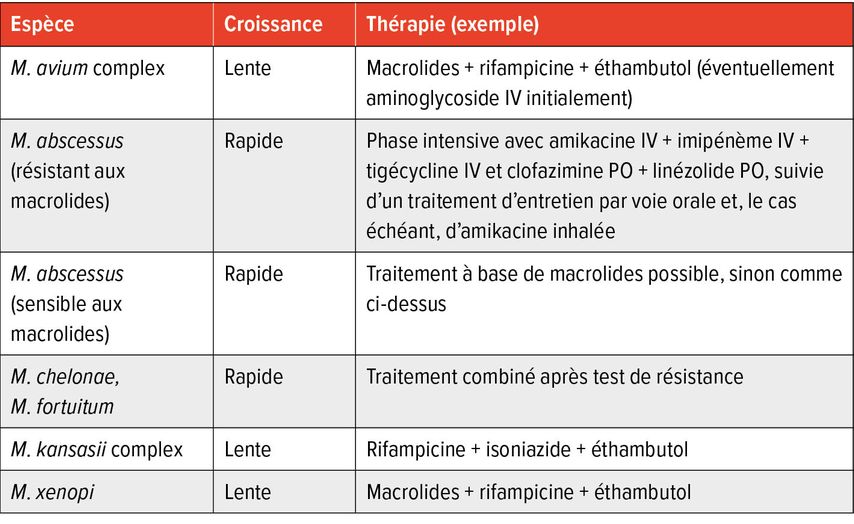
Les traitements sont longs et guidés par les résultats des tests de sensibilité in vitro. En cas d’infection pulmonaire, un traitement ≥12 mois après négativation des cultures est généralement recommandé. Pour les infections des tissus mous traités chirurgicalement, une antibiothérapie prolongée sur plusieurs mois est également indiquée. Le choix optimal des molécules et leur mode l’administration (par voie intraveineuse, orale ou inhalée; quotidienne ou intermittente) dépendent de l’espèce, des manifestations et de la sévérité de la maladie. Les recommandations thérapeutiques des infections pulmonaires à MNT s’appuient sur les guidelines ATS/ERS/ESCMID/IDSA. Pour les formes extrapulmonaires, les décisions reposent souvent sur l’avis d’experts, faute de recommandations thérapeutiques claires. La prévention de l’émergence de résistances, notamment aux macrolides, constitue une priorité. C’est pourquoi les monothérapies sont à proscrire.
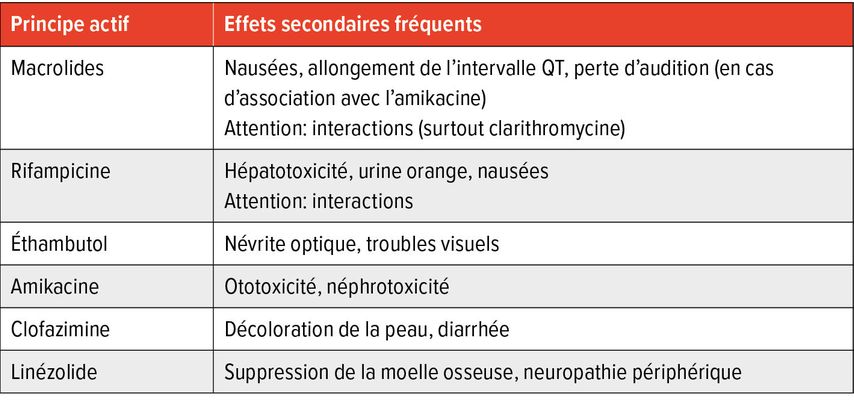
Les options thérapeutiques pour les espèces de MNT cliniquement pertinentes sont détaillées ci-dessous. Un aperçu des schémas recommandés ainsi que des effets indésirables les plus fréquents figure dans les Tableaux 2 et 3.
Mycobacterium avium complex (MAC)
Pour les infections pulmonaires dues à M. avium, M. intracellulare ou M. chimaera, la prise en charge standard repose sur une trithérapie associant un macrolide (azithromycine ou clarithromycine), la rifampicine et l’éthambutol. En présence de cavernes, l’administration quotidienne est recommandée, souvent complétée initialement par de l’amikacine IV; sinon, un traitement trois fois par semaine est suffisant. En cas de récidive, l’ajout d’un aminoglycoside par inhalation doit être envisagé.
Forme nodulaire-bronchiquectique
-
Standard: traitement intermittent (3x/semaine) par azithromycine (ou clarithromycine), rifampicine et éthambutol
-
Durée du traitement: ≥12 mois après la première culture négative
Forme cavitaire/progressive
-
Schéma quotidien: azithromycine (ou clarithromycine), rifampicine et éthambutol
-
Ajout possible d’amikacine IV (3x par semaine, pendant 2–3 mois)
Échec thérapeutique (absence de conversion de culture après 6 mois de traitement)
-
Ajout d’amikacine liposomale inhalée (quotidiennement); si nécessaire, amikacine IV à court terme
Résistances
-
En cas de résistance aux macrolides, la prise en charge devient extrêmement difficile et doit se faire en collaboration avec un centre spécialisé. La pertinence des résistances autres que celles aux macrolides et aux aminoglycosides reste incertaine et justifie un avis spécialisé.
Mycobacterium abscessus
Le traitement de M. abscessus est long, difficile et souvent décevant. Il doit donc être conduit en collaboration avec un centre spécialisé. Le schéma repose généralement sur deux phases: une phase initiale intensive suivie d’une phase d’entretien. Une résection chirurgicale peut être envisagée en cas de lésions localisées.
Phase intensive initiale (au moins 4semaines)
-
Objectif: association de 2–3 antibiotiques IV avec les principaux médicaments oraux (souvent 2)
-
Options: amikacine IV, tigécycline IV, imipénème IV, macrolide (si sensible), clofazimine, linézolide
-
La phase d’induction est souvent hospitalière avec une surveillance rapprochée
Traitement d’entretien
-
Objectif: association d’au moins 3 substances par voie orale et/ou inhalée
-
Options: macrolides (si sensibles), clofazimine, linézolide, amikacine inhalée
-
Durée cumulée: ≥12 mois après obtention de cultures négatives
Les options mentionnées dans les recommandations ATS/ERS/ESCMID/IDSA (céfoxitine, tédizolide, omadacycline) ne sont pas disponibles en Suisse et n’ont donc pas, à ce jour, de rôle pratique en clinique courante.
Mycobacterium chelonae
Le traitement repose également sur une phase intensive IV/PO suivie d’une phase d’entretien orale.
-
Options: macrolides (souvent sensibles), tobramycine, imipénème, linézolide, clofazimine, moxifloxacine
-
Durée: souvent >6 mois; un débridement chirurgical est souvent nécessaire
Pour les infections extrapulmonaires à MNT, une chirurgie d’assainissement est recommandée à chaque fois que possible, associée à un traitement antimicrobien ciblé. Les formes disséminées surviennent surtout chez les personnes immunodéprimées et nécessitent un traitement systémique prolongé, typiquement pendant 1 an après la dernière culture positive. La réduction de l’immunosuppression est souvent un élément crucial pour contrôler l’infection.
Thérapies expérimentales
Dans les formes réfractaires, des approches expérimentales individualisées peuvent être proposées. Ces dernières années, des thérapies phagiques ont montré certains succès. Les cas publiés concernent surtout les infections pulmonaires. La sélection des phages adaptés, ainsi que leur préparation et leur administration complexes, limitent toutefois actuellement leur utilisation à grande échelle.
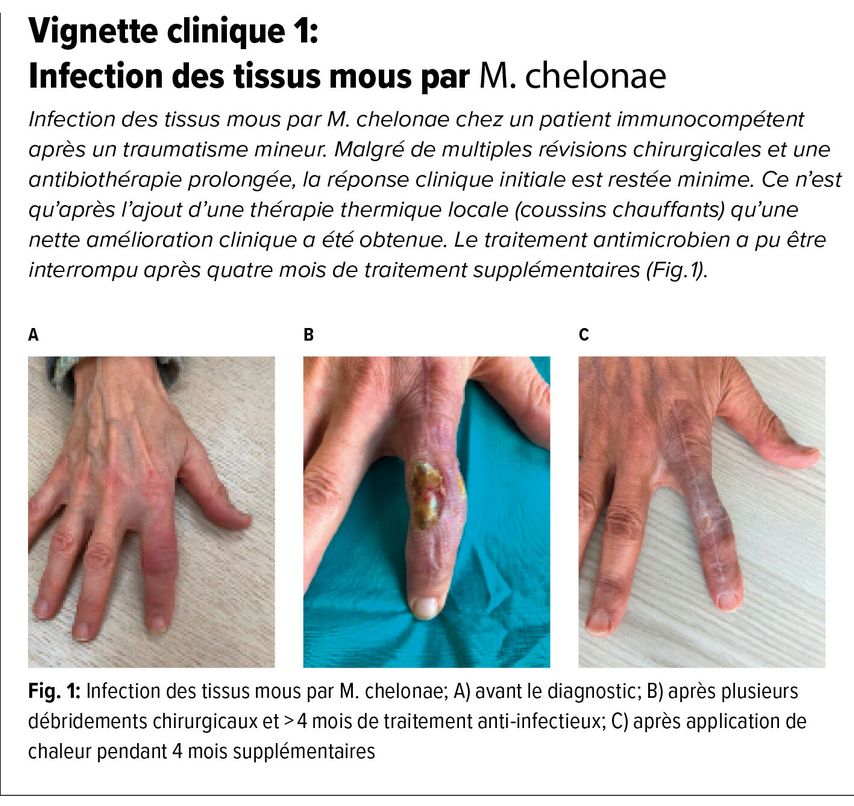
En cas d’infection cutanée ou des tissus mous par des mycobactéries thermosensibles, une thérapie locale par chaleur peut être envisagée. Cette méthode thérapeutique, décrite dans des séries de cas, exploite la propriété microbiologique de certaines mycobactéries de pas se multiplier au-delà de 37°C. L’application locale de chaleur (p.ex. coussins chauffants) peut ainsi contribuer de manière significative à la réponse thérapeutique (voir vignette clinique 1).
L’utilisation et l’efficacité d’antituberculeux de réserve, comme la bédaquiline, font actuellement l’objet de recherches. Actuellement, leur emploi doit rester limité à des cas sélectionnés et encadré par des spécialistes.
Défis et perspectives
Le traitement des maladies dues aux MNT est complexe: longue durée de traitement, effets indésirables fréquents, taux élevé de rechutes. La décision thérapeutique doit être individualisée et multidisciplinaire: toutes les détections de MNT, de même que toutes les maladies associées, ne justifient pas forcément un traitement. L’implication d’une équipe de traitement interdisciplinaire est cruciale, notamment face aux espèces résistantes aux traitements telles M. abscessus ou les MAC résistants aux macrolides.
Les cas complexes dues aux MNT sont discutés de manière collégiale au sein du comité intercantonal des mycobactéries, qui se réunit toutes les deux à quatre semaines. Les cas peuvent être soumis à l’adresse: infektiologie@usz.ch .
Littérature:
disponible auprès des auteur·es
Das könnte Sie auch interessieren:
Points forts du congrès ADA: de la gestion du poids à la thérapie par cellules souches
Du 20 au 23juin, les 85e sessions scientifiques de l’American Diabetes Association (ADA) se sont tenues à Chicago. Ce congrès, le plus grand rendez-vous mondial consacré à la recherche, ...
Principaux faits marquantsdu congrès EASL 2025
Le congrès de l’EASL s’est tenu à Amsterdam du 7 au 10 juin2025 et a réuni près de 7740participant·es issus de 119 pays. L’événement a couvert un large éventail de thématiques en ...
Plan de vaccination suisse 2025: nouveautés
Les principales nouveautés du plan de vaccination suisse 2025 concernent la prévention des maladies respiratoires. Le Dr méd. Alessandro Diana, pédiatre et infectiologue à Genève, membre ...